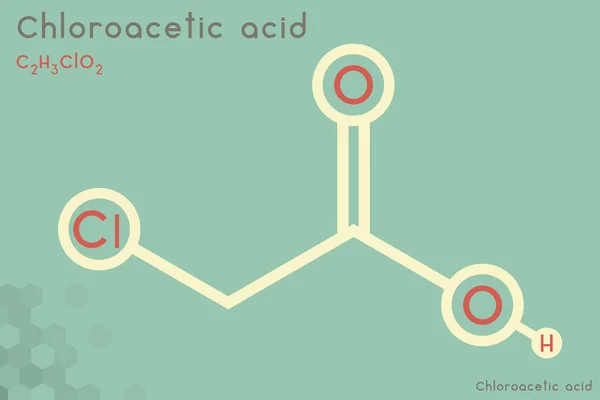
L'acido cloroacetico è il composto organico clorurato di formula ClCH2CO2H, derivato dall'acido acetico sostituendo un idrogeno del gruppo metilico con un atomo di cloro. In condizioni normali è un solido cristallino incolore, facilmente solubile in acqua. È un acido carbossilico importante nell'industria chimica.
Sintesi
L'acido cloroacetico fu sintetizzato per la prima volta da Reinhold Hoffmann nel 1857. Industrialmente se ne producono circa 420 000 tonnellate all'anno, usando due processi. Il primo e più usato è la clorazione dall'acido acetico, usando anidride acetica come catalizzatore:
Inevitabilmente si formano come sottoprodotti anche gli acidi di- e tricloroacetici. La purificazione non è semplice; si usa in genere la cristallizzazione.
Il secondo metodo è l'idrolisi del tricloroetilene usando acido solforico come catalizzatore:
L'acido cloroacetico prodotto per questa via è molto puro, ma questo metodo è sempre meno usato a causa dell'alto costo del tricloroetilene.
Proprietà
L'acido cloroacetico forma cristalli incolori igroscopici di odore pungente, facilmente solubili in acqua e altri solventi organici tra i quali etanolo ed etere dietilico. In soluzione acquosa è un acido molto più forte dell'acido acetico. Ciò è dovuto all'azione dell'atomo di cloro molto elettronegativo che contribuisce a delocalizzare la carica negativa dell'anione, che risulta così stabilizzato.
Uso
L'acido cloroacetico è un importante prodotto industriale. Serve come materia prima per produrre principalmente carbossimetilcellulosa, amido modificato e acido tioglicolico, nonché pesticidi, coloranti e prodotti farmaceutici. Come usi minori, lo si usa in molte altre sintesi organiche per ottenere caffeina, barbiturati, acidi arilacetici, cumarina e vitamina B6.
Indicazioni di sicurezza
L'acido cloroacetico è disponibile in commercio. Il composto è tossico per inalazione, per contatto con la pelle e per ingestione. Provoca gravi ustioni alla pelle e agli occhi. Non ci sono dati che indichino con certezza proprietà cancerogene. Viene considerato molto tossico per gli organismi acquatici.
Note
Bibliografia
- R. Hoffmann, Ueber monochloressigsäure, Heidelberg, 1857.
- G. Koenig, E. Lohmar e N. Rupprich, Chloroacetic Acids, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2002, DOI:10.1002/14356007.a06_537.
Altri progetti
- Wikimedia Commons contiene immagini o altri file su acido cloroacetico
Collegamenti esterni
- (EN) chloroacetic acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.